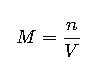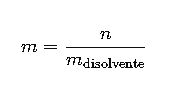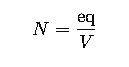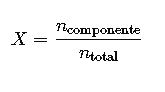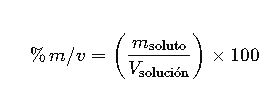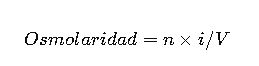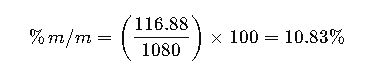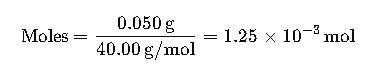La conversión de unidades de concentración es esencial en química analítica, farmacología, ingeniería química y ciencias ambientales. Comprender cómo transformar entre diferentes unidades permite una comunicación precisa y evita errores en la preparación de soluciones y en la interpretación de resultados analíticos.
Calculadora de Concentración
¿Cómo usar la calculadora?
Fórmulas usadas
Porcentaje: % = (masa en g / volumen en L)*100
mg/mL: mg/mL = masa(mg)/volumen(mL)
ppm: ppm = masa(mg)/volumen(L)
Tabla de Conversión de Unidades de Concentración
A continuación, se presenta una tabla detallada con las unidades de concentración más comunes y sus equivalencias:
| Unidad de Concentración | Símbolo | Fórmula | Equivalencia | Aplicación Común |
|---|---|---|---|---|
| Molaridad | M | n/V | moles/L | Laboratorios, síntesis química |
| Molalidad | m | n/m_solvente | moles/kg | Química física, estudios térmicos |
| Normalidad | N | eq/V | eq/L | Valoraciones ácido-base |
| Fracción molar | X | n_soluto/n_total | adimensional | Cálculos termodinámicos |
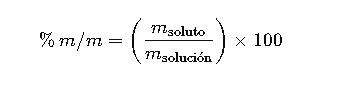
| Porcentaje en masa | % m/m | (m_soluto/m_solución) × 100 | g/g | Preparación de soluciones |
| Porcentaje en volumen | % v/v | (V_soluto/V_solución) × 100 | mL/mL | Industria farmacéutica |
| Porcentaje masa/volumen | % m/v | (m_soluto/V_solución) × 100 | g/mL | Análisis clínicos |
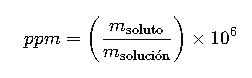
| Partes por millón | ppm | (m_soluto/m_solución) × 10⁶ | mg/L | Análisis ambiental |
| Partes por billón | ppb | (m_soluto/m_solución) × 10⁹ | µg/L | Análisis de trazas |
| Osmolaridad | osmol/L | n × i/V | osmol/L | Estudios osmóticos |
Fórmulas de Conversión de Unidades de Concentración
1. Molaridad (M)
La molaridad se define como el número de moles de soluto por litro de solución:
- n: moles de soluto
- V: volumen de la solución en litros
2. Molalidad (m)
La molalidad se expresa como moles de soluto por kilogramo de disolvente:
- n: moles de soluto
- m_disolvente: masa del disolvente en kilogramos
3. Normalidad (N)
La normalidad se refiere a los equivalentes de soluto por litro de solución:
- eq: equivalentes de soluto
- V: volumen de la solución en litrosScribd
4. Fracción Molar (X)
La fracción molar es la relación entre los moles de un componente y los moles totales en la solución:
- n_componente: moles del componente
- n_total: moles totales en la solución
5. Porcentaje en Masa (% m/m)
El porcentaje en masa indica la masa de soluto por cada 100 gramos de solución:
- m_soluto: masa del soluto en gramos
- m_solución: masa total de la solución en gramos
6. Porcentaje en Volumen (% v/v)
El porcentaje en volumen se refiere al volumen de soluto por cada 100 mililitros de solución:
- V_soluto: volumen del soluto en mililitros
- V_solución: volumen total de la solución en mililitros
7. Porcentaje Masa/Volumen (% m/v)
El porcentaje masa/volumen expresa la masa de soluto por cada 100 mililitros de solución:
- m_soluto: masa del soluto en gramos
- V_solución: volumen total de la solución en mililitros
8. Partes por Millón (ppm)
Las partes por millón se utilizan para expresar concentraciones muy bajas:
- m_soluto: masa del soluto en miligramos
- m_solución: masa total de la solución en gramos
9. Osmolaridad
La osmolaridad considera el número de partículas en solución:
- n: moles de soluto
- i: factor de disociación
- V: volumen de la solución en litros
Ejemplos de Conversión de Unidades de Concentración
Caso 1: Conversión de Molaridad a Porcentaje en Masa
Problema: Convertir una solución 2 M de NaCl a porcentaje en masa.
Solución:
- Calcular los moles de NaCl: 2 moles/L.
- Determinar la masa molar de NaCl: 58.44 g/mol.
- Calcular la masa de NaCl en 1 litro de solución: 2 moles × 58.44 g/mol = 116.88 g.
- Suponer que la densidad de la solución es 1.08 g/mL, por lo que el volumen de 1 litro de solución pesa 1080 g.
- Calcular el porcentaje en masa:
Resultado: La solución tiene un 10.83% en masa de NaCl.
Caso 2: Conversión de ppm a Molaridad
Problema: Convertir una concentración de 50 ppm de NaOH a molaridad.
Solución:
- Convertir ppm a gramos por litro: 50 ppm = 50 mg/L = 0.050 g/L.
- Determinar la masa molar de NaOH: 40.00 g/mol.
- Calcular los moles de NaOH:
- Como el volumen es 1 litro, la molaridad es 1.25 × 10⁻³ M.
Resultado: La concentración es 1.25 × 10⁻³ M.
Recomendaciones Prácticas
- Precisión en Mediciones: Utilizar balanzas y cilindros medidores calibrados para obtener resultados precisos.
- Condiciones Ambientales: Considerar la temperatura, ya que puede afectar la densidad y volumen de la solución.
- Uso de Factores de Conversión: Emplear factores de conversión adecuados para transformar entre unidades de concentración.
- Verificación de Resultados: Comprobar las unidades en cada paso del cálculo para evitar errores.