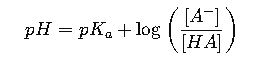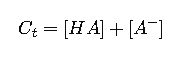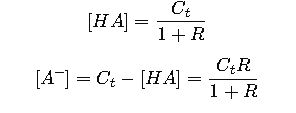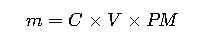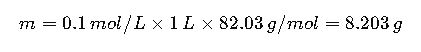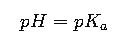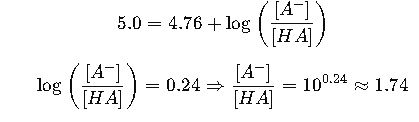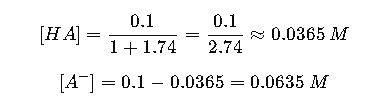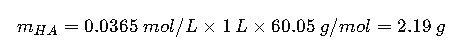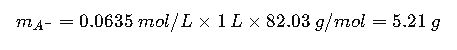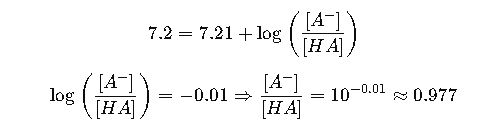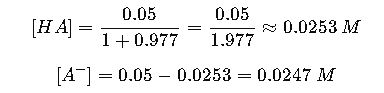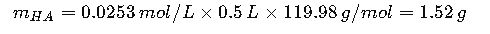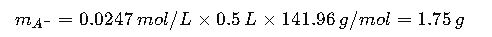Las soluciones tampón o buffers son esenciales para mantener pH estable en procesos químicos y bioquímicos.
Este artículo presenta tablas, fórmulas, explicaciones y ejemplos prácticos para preparar soluciones tampón efectivas.
Calculadora de Soluciones Tampón (Buffers)
Tablas con valores comunes para la preparación de soluciones tampón
A continuación se presentan tablas con las concentraciones y combinaciones más frecuentes para preparar soluciones tampón en laboratorio. Estos valores son estándar y ampliamente utilizados en investigación y procesos industriales.
| Tampón | Compuestos principales | pKa (a 25°C) | Rango efectivo de pH | Concentración típica (M) | Uso común |
|---|---|---|---|---|---|
| Tampón Fosfato (PBS) | NaH2PO4 / Na2HPO4 | 7.21 | 6.8 – 7.4 | 0.01 – 0.1 | Biología molecular, cultivo celular |
| Tampón Acetato | Ácido acético / Acetato de sodio | 4.76 | 3.8 – 5.8 | 0.05 – 0.2 | Enzimas, proteínas |
| Tampón Tris-HCl | Tris base / Tris-HCl | 8.06 | 7.0 – 9.0 | 0.01 – 0.2 | Biología molecular, buffers de pH alcalino |
| Tampón Citrato | Ácido cítrico / Citrato de sodio | 3.13, 4.76, 6.40 | 3.0 – 6.5 | 0.01 – 0.1 | Procesos bioquímicos |
| Tampón Carbonato | Ácido carbónico / Carbonato de sodio | 6.37, 10.33 | 9.2 – 10.8 | 0.01 – 0.1 | Reacciones en pH básico |
| Compuesto | Masa molar (g/mol) | pKa principal | Solubilidad en agua (g/100 mL a 25°C) | Notas adicionales |
|---|---|---|---|---|
| Ácido acético | 60.05 | 4.76 | Ilimitada | Uso común para tampón ácido |
| Acetato de sodio | 82.03 | N/A | 119 | Base conjugada para acetato |
| Ácido fosfórico | 97.99 | 2.15, 7.21, 12.32 | Alta | Multiprotico, útil en fosfato |
| Fosfato monobásico (NaH2PO4) | 119.98 | 7.21 | Alta | Tampón fosfato |
| Fosfato dibásico (Na2HPO4) | 141.96 | N/A | Alta | Tampón fosfato |
| Tris base | 121.14 | 8.06 | Alta | Tampón alcalino |
Fórmulas esenciales para la preparación de soluciones tampón (buffers)
La base matemática y química para preparar un tampón eficaz implica el equilibrio ácido-base y el cálculo preciso de las concentraciones para alcanzar el pH deseado. A continuación se detallan las fórmulas fundamentales con sus variables.
1. Ecuación de Henderson-Hasselbalch
La ecuación fundamental para calcular el pH de una solución tampón es:
- pH: Potencial de hidrógeno de la solución.
- pK_a: Constante de disociación ácida del ácido débil (característica del ácido).
- [A⁻]: Concentración de la base conjugada (forma desprotonada).
- [HA]: Concentración del ácido débil (forma protonada).
Explicación:
Para preparar un tampón con un pH deseado, se debe ajustar la relación molar entre la base conjugada y el ácido débil conforme a esta ecuación. Por ejemplo, si el pKa del ácido es 4.76 (ácido acético), para un pH 5.0, la relación ![]() se calcula para mantener ese pH.
se calcula para mantener ese pH.
2. Cálculo de concentraciones para un volumen específico
Para preparar una solución tampón con concentración total Ct (sumatoria ácido + base), se usa:
Si se conoce la relación 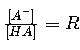 entonces:
entonces:
Esto permite calcular las cantidades exactas de ácido y base que se deben mezclar.
3. Cálculo de masa para preparar el tampón
Para un volumen V (litros) de tampón, la masa m del compuesto necesario es:
- C: concentración molar (mol/L) del ácido o base.
- V: volumen total de la solución (L).
- PM: peso molecular (g/mol) del compuesto.
Ejemplo: Para preparar 1 L de tampón acetato 0.1 M, la masa de acetato de sodio (base conjugada) es:
4. Efecto del pH y pKa en la capacidad tampón
La capacidad tampón máxima se da cuando:
La capacidad decrece a medida que el pH se aleja del pKa ±1. Esto es fundamental para seleccionar el ácido/base conjugada adecuada.
Explicación detallada de variables comunes en la preparación de tampón
| Variable | Descripción técnica | Valores típicos / Comentarios |
|---|---|---|
| pH | Nivel de acidez o basicidad del tampón | Entre 3 y 10 para la mayoría de tampón comunes |
| pKa | Constante de disociación ácida del ácido débil | Depende del compuesto; ácido acético = 4.76; Tris = 8.06 |
| [HA] | Concentración molar del ácido débil | Depende de la preparación, usualmente entre 0.01 M y 0.2 M |
| [A⁻] | Concentración molar de la base conjugada | Complementaria a [HA], se ajusta para mantener pH |
| C_t | Concentración total del tampón (suma de ácido y base) | Variable según necesidad, 0.01 a 0.2 M comúnmente |
| V | Volumen total de la solución preparada | En litros o mililitros según requerimiento |
| PM | Peso molecular del compuesto | Dato fijo, necesario para cálculo de masa |
Casos prácticos detallados en preparación de soluciones tampón
Caso 1: Preparación de 1 L de tampón acetato pH 5.0 con concentración total 0.1 M
Datos:
- Ácido acético pKa=4.76
- Volumen deseado V=1 L
- Concentración total Ct=0.1 M
- pH deseado pH=5.0
Paso 1: Calcular la relación base/ácido
Usamos Henderson-Hasselbalch:
Paso 2: Calcular concentraciones de ácido y base
Paso 3: Calcular masa de ácido acético y acetato de sodio
- Ácido acético (PM = 60.05 g/mol):
- Acetato de sodio (PM = 82.03 g/mol):
Paso 4: Procedimiento
Disolver 2.19 g de ácido acético y 5.21 g de acetato de sodio en menos de 1 L de agua destilada, ajustar pH con ácido/base si es necesario y completar volumen a 1 L.
Caso 2: Preparación de tampón fosfato pH 7.2 para cultivo celular, 0.05 M, 500 mL
Datos:
- Tampón fosfato: mezcla de NaH2PO4 y Na2HPO4
- pKa = 7.21
- pH deseado = 7.2
- Concentración total = 0.05 M
- Volumen = 0.5 L
Paso 1: Calcular relación base/ácido
Paso 2: Calcular concentraciones
Paso 3: Calcular masa de cada compuesto
- NaH2PO4 (PM = 119.98 g/mol):
- Na2HPO4 (PM = 141.96 g/mol):
Paso 4: Procedimiento
Disolver 1.52 g de NaH2PO4 y 1.75 g de Na2HPO4 en aproximadamente 400 mL de agua, ajustar pH con ácido o base si es necesario, y completar volumen a 500 mL.
Variables adicionales y recomendaciones para la preparación precisa
- Temperatura: El pKa varía con la temperatura, por lo que los cálculos deben ajustarse si la temperatura de trabajo es diferente a 25 °C.
- Ionicidad: La fuerza iónica de la solución afecta el pKa y el pH efectivo.
- Pureza y calidad de reactivos: Es recomendable utilizar reactivos grado analítico para evitar interferencias.
- Ajuste fino de pH: Uso de un pH-metro calibrado y ajuste con ácido o base fuerte en pequeñas cantidades para obtener pH exacto.
- Almacenamiento: Los buffers deben almacenarse en condiciones que eviten contaminación y degradación.
Recursos adicionales y normativa recomendada
- Normas y guías internacionales:
- IUPAC, «Quantities, Units and Symbols in Physical Chemistry» (Gold Book)
- Standard Methods for the Examination of Water and Wastewater (APHA)
- NIST Buffer Standards: https://www.nist.gov/srm
- Herramientas útiles:
- Calculadoras de pH tampón en línea (por ejemplo, https://buffercalculator.org)
- Software de simulación química para equilibrio ácido-base
Métodos experimentales para validar la preparación
- Medición del pH: Utilizar un pH-metro calibrado con soluciones estándar (pH 4, 7, 10).
- Titulación ácido-base: Confirmar concentración efectiva y composición.
- Control de temperatura: Realizar mediciones a la temperatura de uso final.
- Evaluación de capacidad tampón: Medir la resistencia del pH ante la adición de ácido o base fuerte.
Buenas prácticas en la preparación y almacenamiento
- Usar agua destilada o ultrapura para evitar contaminantes.
- Preparar soluciones frescas o almacenar a 4°C para evitar degradación.
- Usar recipientes limpios y preferiblemente de vidrio o plástico inerte.
- Etiquetar claramente con concentración, pH, fecha y composición.