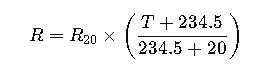Cálculo de masa depositada o liberada en electrólisis (leyes de Faraday)
El cálculo de masa depositada o liberada en electrólisis determina la cantidad exacta de sustancia transformada. Este proceso es fundamental para aplicaciones industriales y científicas.
En este artículo se explican las leyes de Faraday, fórmulas, tablas de valores comunes y ejemplos prácticos para un entendimiento profundo. Se abordarán casos reales y herramientas para optimizar cálculos.
Calculadora con inteligencia artificial (IA) para Cálculo de masa depositada o liberada en electrólisis (leyes de Faraday)
- Calcular masa depositada de cobre con corriente de 2 A durante 30 minutos.
- Determinar masa liberada de plata con carga eléctrica de 5000 C.
- Calcular tiempo necesario para depositar 0.5 g de zinc con corriente de 1.5 A.
- Obtener masa depositada de aluminio con corriente de 3 A y tiempo de 1 hora.
Tablas de valores comunes para el cálculo de masa en electrólisis
Para realizar cálculos precisos en electrólisis, es esencial conocer los valores de constantes y propiedades de los elementos más comunes. A continuación, se presentan tablas con datos fundamentales para el cálculo de masa depositada o liberada.
| Elemento | Símbolo | Valencia (n) | Masa Atómica (g/mol) | Equivalente Electroquímico (g/C) | Aplicaciones comunes |
|---|---|---|---|---|---|
| Cobre | Cu | 2 | 63.55 | 0.000329 | Electrodeposición, fabricación de circuitos |
| Plata | Ag | 1 | 107.87 | 0.001118 | Electrónica, joyería |
| Plomo | Pb | 2 | 207.2 | 0.000101 | Baterías, protección contra corrosión |
| Hierro | Fe | 3 | 55.85 | 0.000193 | Industria metalúrgica, galvanoplastia |
| Zinc | Zn | 2 | 65.38 | 0.000321 | Galvanización, protección anticorrosiva |
| Aluminio | Al | 3 | 26.98 | 0.000178 | Industria aeroespacial, recubrimientos |
| Hidrógeno | H | 1 | 1.008 | 0.001035 | Producción de hidrógeno, pilas de combustible |
| Oxígeno | O | 2 | 16.00 | 0.000167 | Electrólisis del agua, procesos industriales |
La columna de equivalente electroquímico (g/C) se calcula como la masa atómica dividida entre el número de electrones transferidos y la constante de Faraday, y es fundamental para determinar la masa depositada o liberada por unidad de carga.
Fórmulas para el cálculo de masa depositada o liberada en electrólisis
Las leyes de Faraday establecen la relación directa entre la cantidad de electricidad que pasa por un electrolito y la cantidad de sustancia depositada o liberada en los electrodos. A continuación, se presentan las fórmulas esenciales para realizar estos cálculos.
Primera ley de Faraday
La masa (m) de una sustancia depositada o liberada es directamente proporcional a la cantidad de carga eléctrica (Q) que pasa por el electrolito.
m = Z × Q
- m: masa depositada o liberada (gramos, g)
- Z: equivalente electroquímico (g/C)
- Q: carga eléctrica total (culombios, C)
El equivalente electroquímico Z se define como:
Z = M / (n × F)
- M: masa molar del elemento o compuesto (g/mol)
- n: número de electrones transferidos por ion (valencia)
- F: constante de Faraday (96485 C/mol)
Segunda ley de Faraday
Cuando la misma cantidad de electricidad pasa a través de diferentes electrolitos, las masas depositadas o liberadas son proporcionales a sus masas equivalentes.
Esto implica que para diferentes sustancias:
m₁ / m₂ = E₁ / E₂
- m₁, m₂: masas depositadas o liberadas de sustancias 1 y 2
- E₁, E₂: masas equivalentes de sustancias 1 y 2
Cálculo de carga eléctrica (Q)
La carga eléctrica total que pasa por el electrolito se calcula como:
Q = I × t
- I: corriente eléctrica (amperios, A)
- t: tiempo durante el cual fluye la corriente (segundos, s)
Fórmula combinada para masa depositada o liberada
Combinando las fórmulas anteriores, la masa depositada o liberada se calcula como:
m = (M × I × t) / (n × F)
- m: masa depositada o liberada (g)
- M: masa molar (g/mol)
- I: corriente (A)
- t: tiempo (s)
- n: número de electrones transferidos
- F: constante de Faraday (96485 C/mol)
Relación con la cantidad de sustancia (moles)
La cantidad de sustancia (número de moles) depositada o liberada se puede calcular como:
n_{mol} = Q / (n × F) = (I × t) / (n × F)
- n_{mol}: moles de sustancia depositada o liberada
Explicación detallada de cada variable y valores comunes
- Masa molar (M): Es la masa de un mol de átomos o moléculas de la sustancia, expresada en gramos por mol (g/mol). Por ejemplo, para el cobre es 63.55 g/mol.
- Número de electrones transferidos (n): Representa la valencia o cantidad de electrones que participan en la reacción electroquímica por ion. Por ejemplo, para Cu²⁺, n = 2.
- Constante de Faraday (F): Es la carga eléctrica por mol de electrones, con un valor estándar de 96485 C/mol.
- Corriente eléctrica (I): Es la intensidad de corriente que fluye a través del electrolito, medida en amperios (A).
- Tiempo (t): Duración durante la cual la corriente fluye, expresada en segundos (s).
- Carga eléctrica (Q): Producto de la corriente por el tiempo, representando la cantidad total de electricidad que pasa por el sistema, en culombios (C).
- Masa depositada o liberada (m): Cantidad de sustancia que se acumula o se libera en el electrodo, medida en gramos (g).
Ejemplos prácticos y aplicaciones reales
Ejemplo 1: Deposición de cobre en galvanoplastia
Una corriente constante de 3 amperios pasa a través de una solución de sulfato de cobre durante 45 minutos. Calcule la masa de cobre depositada en el cátodo.
- Datos:
- I = 3 A
- t = 45 minutos = 45 × 60 = 2700 s
- M (Cu) = 63.55 g/mol
- n (Cu²⁺) = 2
- F = 96485 C/mol
Primero, calculamos la carga eléctrica total:
Q = I × t = 3 A × 2700 s = 8100 C
Luego, aplicamos la fórmula para la masa depositada:
m = (M × Q) / (n × F) = (63.55 g/mol × 8100 C) / (2 × 96485 C/mol)
m = (514455) / (192970) ≈ 2.67 g
Por lo tanto, se depositan aproximadamente 2.67 gramos de cobre en el cátodo.
Ejemplo 2: Liberación de plata en un proceso electroquímico
Se aplica una corriente de 1.5 A durante 20 minutos en una celda con electrodos de plata. Determine la masa de plata liberada en el ánodo.
- Datos:
- I = 1.5 A
- t = 20 minutos = 1200 s
- M (Ag) = 107.87 g/mol
- n (Ag⁺) = 1
- F = 96485 C/mol
Calculamos la carga eléctrica:
Q = I × t = 1.5 A × 1200 s = 1800 C
Calculamos la masa liberada:
m = (M × Q) / (n × F) = (107.87 g/mol × 1800 C) / (1 × 96485 C/mol)
m = 194166 / 96485 ≈ 2.01 g
La masa de plata liberada es aproximadamente 2.01 gramos.
Aplicaciones industriales y científicas del cálculo de masa en electrólisis
El cálculo preciso de la masa depositada o liberada en electrólisis es crucial en múltiples sectores:
- Industria metalúrgica: Para la obtención y purificación de metales como cobre, plata, zinc y aluminio mediante electrodeposición.
- Fabricación de baterías: Control de la cantidad de material activo depositado en electrodos para optimizar rendimiento y vida útil.
- Tratamiento de aguas: Uso de electrólisis para eliminar contaminantes mediante deposición controlada de sustancias químicas.
- Producción de gases: Electrolisis del agua para generación de hidrógeno y oxígeno con control exacto de cantidades producidas.
- Electrónica: Fabricación de circuitos impresos y recubrimientos conductores mediante galvanoplastia.
Consideraciones prácticas y factores que afectan el cálculo
En la práctica, varios factores pueden influir en la precisión del cálculo de masa depositada o liberada:
- Eficiencia Farádica: No toda la corriente contribuye a la reacción deseada; la eficiencia puede ser menor al 100% debido a reacciones secundarias.
- Pureza del electrolito: Impurezas pueden alterar la transferencia de electrones y la masa depositada.
- Condiciones de temperatura y presión: Afectan la conductividad y la cinética de la reacción electroquímica.
- Superficie del electrodo: La rugosidad y área efectiva influyen en la uniformidad y cantidad de depósito.
- Concentración iónica: La concentración del ion en solución determina la disponibilidad para la reacción.
Por ello, en aplicaciones industriales se realizan calibraciones y ajustes para garantizar resultados confiables.
Recursos y enlaces externos para profundizar en el tema
- Faraday’s Laws of Electrolysis – ChemEurope
- Electrochemistry Fundamentals – NDE Education
- Electrolysis and Faraday’s Laws – Journal of Chemical Education
- Faraday Constant and Electrolysis Calculations – Engineering Toolbox
Resumen técnico y recomendaciones para el cálculo
El cálculo de masa depositada o liberada en electrólisis mediante las leyes de Faraday es una herramienta esencial para el control y diseño de procesos electroquímicos. La correcta aplicación de las fórmulas y el conocimiento de las variables involucradas permiten optimizar la eficiencia y calidad de los productos obtenidos.
Se recomienda siempre verificar la eficiencia farádica experimental y considerar las condiciones operativas para ajustar los cálculos teóricos. El uso de tablas con valores actualizados y calculadoras inteligentes facilita la precisión y rapidez en la toma de decisiones técnicas.