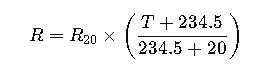Cálculo de entalpía (ΔH): fundamentos y aplicaciones avanzadas
El cálculo de entalpía (ΔH) es esencial para entender procesos energéticos en química y termodinámica. Este artículo explica métodos, fórmulas y aplicaciones prácticas.
Descubra cómo calcular ΔH con precisión, interpretar resultados y aplicar conceptos en casos reales industriales y académicos.
Calculadora con inteligencia artificial (IA) para Cálculo de entalpía (ΔH)
- Calcular ΔH de combustión del metano a 25°C y 1 atm.
- Determinar ΔH de reacción para la formación de agua a partir de hidrógeno y oxígeno.
- Evaluar ΔH de fusión del hielo a presión atmosférica.
- Obtener ΔH de neutralización entre ácido clorhídrico y hidróxido de sodio.
Valores comunes de entalpía: tablas de referencia
Para realizar cálculos precisos de entalpía, es fundamental contar con tablas confiables de entalpías estándar de formación, combustión y reacción. A continuación, se presentan tablas extensas con valores comunes, expresados en kJ/mol, a 25°C y 1 atm.
| Compuesto | ΔH°f (kJ/mol) | Estado | Fuente |
|---|---|---|---|
| H2(g) | 0 | Gas | Tabla NIST |
| O2(g) | 0 | Gas | Tabla NIST |
| H2O(l) | -285.83 | Líquido | Tabla NIST |
| H2O(g) | -241.82 | Gas | Tabla NIST |
| CO2(g) | -393.5 | Gas | Tabla NIST |
| CH4(g) | -74.8 | Gas | Tabla NIST |
| C2H6(g) | -84.7 | Gas | Tabla NIST |
| NH3(g) | -45.9 | Gas | Tabla NIST |
| NaOH(s) | -425.6 | Sólido | Tabla NIST |
| HCl(g) | -92.3 | Gas | Tabla NIST |
| CH3OH(l) | -238.7 | Líquido | Tabla NIST |
| C6H12O6(s) (glucosa) | -1273.3 | Sólido | Tabla NIST |
| Fe(s) | 0 | Sólido | Tabla NIST |
| Fe2O3(s) | -824.2 | Sólido | Tabla NIST |
| CaCO3(s) | -1206.9 | Sólido | Tabla NIST |
| CO(g) | -110.5 | Gas | Tabla NIST |
| NO2(g) | 33.2 | Gas | Tabla NIST |
| SO2(g) | -296.8 | Gas | Tabla NIST |
| H2SO4(l) | -814.0 | Líquido | Tabla NIST |
Estos valores son fundamentales para el cálculo de entalpía estándar de reacción y otros procesos termodinámicos.
Fórmulas esenciales para el cálculo de entalpía (ΔH)
El cálculo de entalpía (ΔH) se basa en la primera ley de la termodinámica y en la definición de entalpía como una función de estado. A continuación, se presentan las fórmulas más utilizadas, explicando cada variable y su significado.
1. Entalpía estándar de reacción
La entalpía estándar de reacción se calcula mediante la diferencia entre las entalpías estándar de formación de productos y reactivos:
- ΔH°reacción: entalpía estándar de la reacción (kJ/mol)
- νp: coeficientes estequiométricos de los productos
- νr: coeficientes estequiométricos de los reactivos
- ΔH°f: entalpía estándar de formación de cada sustancia (kJ/mol)
Este método es el más común para determinar ΔH en reacciones químicas a condiciones estándar (25°C, 1 atm).
2. Cálculo de entalpía a partir de calor y presión
En procesos a presión constante, la entalpía se relaciona con el calor absorbido o liberado:
- ΔH: cambio de entalpía (J o kJ)
- qp: calor a presión constante (J o kJ)
Este principio es fundamental en calorimetría para medir cambios de entalpía en reacciones o cambios de estado.
3. Entalpía de formación y combustión
La entalpía estándar de formación (ΔH°f) es la variación de entalpía al formar un mol de compuesto a partir de sus elementos en estado estándar. La entalpía de combustión (ΔH°comb) es la energía liberada al quemar un mol de sustancia.
Para combustión:
Generalmente, los productos son CO2 y H2O, y los reactivos incluyen el combustible y O2.
4. Ley de Hess
La ley de Hess permite calcular ΔH de una reacción compleja sumando ΔH de reacciones intermedias:
Esto es útil cuando no se puede medir directamente ΔH de la reacción deseada.
5. Cálculo de entalpía a partir de capacidad calorífica
Para cambios de temperatura sin cambio de fase, ΔH se calcula con:
- n: número de moles
- Cp: capacidad calorífica a presión constante (J/mol·K)
- ΔT: cambio de temperatura (K o °C)
Este cálculo es esencial en procesos térmicos y diseño de reactores.
Variables comunes y sus valores típicos
- ΔH°f: varía según compuesto, desde 0 para elementos en estado estándar hasta valores negativos o positivos para compuestos.
- Cp: depende del material, por ejemplo, agua líquida ≈ 75.3 J/mol·K, aire ≈ 29 J/mol·K.
- Temperatura y presión: condiciones estándar son 25°C (298 K) y 1 atm, pero pueden variar según aplicación.
- Coeficientes estequiométricos: determinados por la ecuación química balanceada.
Ejemplos prácticos detallados de cálculo de entalpía (ΔH)
Ejemplo 1: Cálculo de ΔH de combustión del metano (CH4)
La combustión del metano se representa como:
Usando la fórmula de entalpía estándar de reacción:
Insertando valores de la tabla:
- ΔH°f(CO2) = -393.5 kJ/mol
- ΔH°f(H2O) = -285.83 kJ/mol
- ΔH°f(CH4) = -74.8 kJ/mol
- ΔH°f(O2) = 0 kJ/mol
Cálculo:
Interpretación: La combustión del metano libera 890.36 kJ por mol, indicando un proceso exotérmico.
Ejemplo 2: Cálculo de ΔH en la neutralización ácido-base
Reacción entre ácido clorhídrico y hidróxido de sodio:
La entalpía de neutralización estándar para esta reacción es aproximadamente -57.3 kJ/mol, valor experimental ampliamente aceptado.
Si se mezclan 0.5 moles de HCl con 0.5 moles de NaOH, el calor liberado será:
Esto indica que se liberan 28.65 kJ de energía en forma de calor, confirmando la naturaleza exotérmica de la neutralización.
Ampliación y consideraciones avanzadas en el cálculo de entalpía
El cálculo de entalpía puede complicarse cuando se consideran condiciones no estándar, mezclas, o reacciones en fases múltiples. En estos casos, se deben tener en cuenta:
- Corrección por temperatura: La entalpía varía con la temperatura, por lo que se utilizan capacidades caloríficas para ajustar valores.
- Presión y volumen: En procesos a presión variable, la relación entre entalpía y energía interna cambia.
- Estados físicos: Cambios de fase implican entalpías de fusión, vaporización o sublimación, que deben sumarse o restarse.
- Reacciones en solución: La entalpía puede depender de la concentración y la interacción entre especies.
- Uso de tablas termodinámicas y software: Herramientas computacionales permiten cálculos más precisos y manejo de datos complejos.
Por ejemplo, para ajustar ΔH a una temperatura T diferente de 25°C, se puede usar la siguiente expresión:
- ΔHT: entalpía a temperatura T
- ΔH°: entalpía estándar a 298 K
- ΔCp: diferencia de capacidades caloríficas entre productos y reactivos
Este ajuste es crucial en ingeniería química y procesos industriales donde las condiciones operativas varían.
Recursos y referencias externas para profundizar en el cálculo de entalpía
- NIST Chemistry WebBook: Base de datos oficial con valores termodinámicos confiables.
- ChemEurope – Enthalpy: Explicaciones técnicas y ejemplos.
- Engineering Toolbox – Enthalpy: Herramientas y tablas para ingenieros.
- ScienceDirect – Enthalpy: Artículos científicos y revisiones actualizadas.
Estos recursos permiten validar datos, ampliar conocimientos y aplicar cálculos en contextos profesionales.