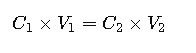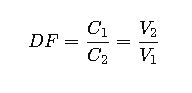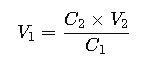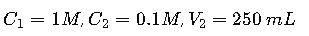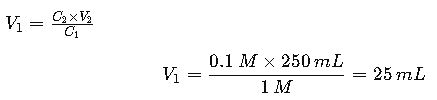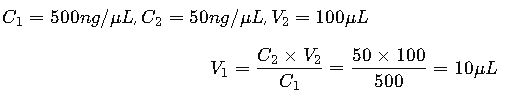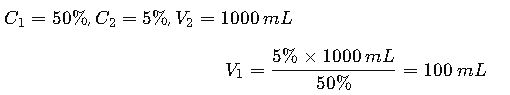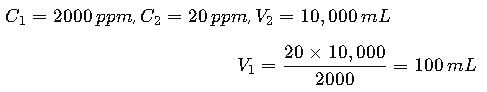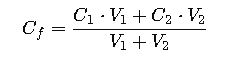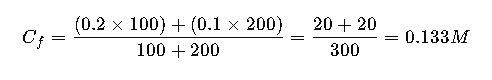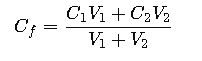El cálculo de dilución es esencial en química analítica, farmacología, bioquímica e ingeniería ambiental.
Permite reducir concentración manteniendo sustancia constante; esta guía técnica presenta fundamentos, fórmulas y ejemplos.
Calculadora de Dilución (C₁·V₁ = C₂·V₂)
Tablas de Valores Comunes en el Cálculo de Diluciones
A continuación se presentan tablas de referencia con valores comúnmente empleados en diluciones típicas en laboratorios y procesos industriales.
Tabla 1: Factores de dilución frecuentes
| Concentración Inicial (M) | Concentración Final (M) | Factor de Dilución (DF) |
|---|---|---|
| 1.0 | 0.1 | 10 |
| 1.0 | 0.01 | 100 |
| 0.5 | 0.05 | 10 |
| 0.5 | 0.005 | 100 |
| 0.2 | 0.02 | 10 |
| 0.1 | 0.001 | 100 |
| 0.05 | 0.0005 | 100 |
| 2.0 | 1.0 | 2 |
| 1.5 | 0.5 | 3 |
Tabla 2: Volúmenes típicos para preparación de soluciones diluidas
| Volumen Final (mL) | Volumen de Solución Concentrada (mL) | Volumen de Disolvente (mL) |
|---|---|---|
| 100 | 10 | 90 |
| 100 | 1 | 99 |
| 1000 | 100 | 900 |
| 1000 | 10 | 990 |
| 250 | 25 | 225 |
| 500 | 50 | 450 |
| 200 | 20 | 180 |
Fórmulas Fundamentales para el Cálculo de Diluciones
1. Ecuación General de Dilución
Donde:
- C₁: Concentración inicial (antes de la dilución)
- V₁: Volumen de solución concentrada a diluir
- C₂: Concentración final deseada
- V₂: Volumen final después de la dilución
Esta fórmula permite calcular cualquiera de las variables si se conocen las otras tres.
Valores comunes de referencia:
- Concentraciones en M (mol/L), mg/mL, %, ppm.
- Volúmenes en mL, L o µL.
2. Factor de dilución
Donde:
- DF: Factor de dilución (cuántas veces se diluye la solución original)
- Se interpreta como: 1 parte de solución concentrada + (DF – 1) partes de disolvente.
3. Cálculo de volumen necesario para dilución
Esta variante de la fórmula es útil cuando se desea saber qué volumen de una solución madre se necesita para preparar un volumen final con concentración deseada.
Casos de Aplicación Real: Ejemplos Detallados
Caso 1: Preparación de una solución diluida de ácido clorhídrico
Situación: Un técnico de laboratorio necesita preparar 250 mL de HCl 0.1 M a partir de una solución comercial concentrada de HCl 1 M.
Solución:
- Datos:
- Usamos:
El técnico debe tomar 25 mL de HCl concentrado y agregar agua destilada hasta completar 250 mL.
Importante: Siempre añadir ácido al agua, nunca al revés, por razones de seguridad.
Caso 2: Dilución de una solución madre de ADN
Situación: Un laboratorio de biotecnología necesita diluir una solución madre de ADN de 500 ng/µL a 50 ng/µL en un volumen final de 100 µL.
Solución:
El investigador debe tomar 10 µL de la solución madre y añadir 90 µL de buffer o agua para obtener 100 µL a 50 ng/µL.
Caso 3: Dilución en la industria farmacéutica
Situación: Se desea preparar 1 L de una solución intravenosa de glucosa al 5% a partir de una solución madre al 50%.
Solución:
Se deben mezclar 100 mL de glucosa al 50% con 900 mL de agua estéril para inyección.
Caso 4: Dilución en tratamiento de aguas
Situación: Un ingeniero ambiental debe preparar 10 L de una solución de hipoclorito de sodio a 20 ppm a partir de una solución madre de 2000 ppm.
Solución:
El ingeniero debe tomar 100 mL de la solución madre y añadir 9.9 L de agua potable para completar 10 L.
Variaciones Avanzadas: Diluciones Sucesivas y Mezclas
Diluciones sucesivas
Cuando la concentración deseada es muy baja, es recomendable usar diluciones en serie para evitar errores volumétricos.
Ejemplo:
Se desea pasar de 1 M a 0.001 M (factor 1000):
- 1ª dilución: 1 M → 0.1 M (DF = 10)
- 2ª dilución: 0.1 M → 0.01 M (DF = 10)
- 3ª dilución: 0.01 M → 0.001 M (DF = 10)
Mezclas de soluciones de diferentes concentraciones
Para calcular la concentración final al mezclar dos soluciones:
Ejemplo:
100 mL de NaCl 0.2 M + 200 mL de NaCl 0.1 M:
Normativas y Estándares Relevantes
- USP (United States Pharmacopeia): Normas para soluciones estándar en farmacología.
- ISO 17025: Requisitos generales para laboratorios de ensayo y calibración.
- EPA (Environmental Protection Agency): Requisitos de diluciones para aguas y residuos.
Las diluciones deben documentarse según Buenas Prácticas de Laboratorio (BPL), registrando fecha, lote, operador y material volumétrico utilizado para asegurar trazabilidad y reproducibilidad.
Lista de Verificación para Cálculo de Diluciones
- Identificar concentración inicial y deseada
- Verificar unidades compatibles
- Calcular volumen requerido con fórmula
- Usar material volumétrico adecuado
- Mezclar y homogeneizar
- Etiquetar correctamente
- Registrar en bitácora o software LIMS
Preguntas Frecuentes sobre el Cálculo de Dilución de Soluciones
1. ¿Qué es una dilución y por qué se realiza?
Una dilución consiste en disminuir la concentración de un soluto en una solución añadiendo más disolvente. Se realiza para obtener concentraciones adecuadas para experimentos, análisis, tratamientos o procesos industriales.
2. ¿Cómo se aplica la fórmula C1×V1=C2×V2?
Esta fórmula relaciona concentración y volumen antes y después de la dilución. Si conocemos tres variables, podemos despejar la cuarta para calcular la cantidad necesaria de solución o disolvente.
3. ¿Qué unidades se pueden usar en el cálculo de diluciones?
Se pueden usar unidades de concentración como molaridad (M), porcentaje masa/volumen (% m/v), partes por millón (ppm), o unidades específicas como ng/µL, siempre que se mantengan consistentes. Los volúmenes comúnmente se miden en mL, L o µL.
4. ¿Qué precauciones debo tener al preparar una solución diluida?
Usar material volumétrico calibrado, añadir ácido al agua y no al revés (en soluciones ácidas), mezclar bien para homogeneizar, y trabajar bajo condiciones seguras y limpias.
5. ¿Qué es una dilución en serie o dilución sucesiva?
Es una técnica que consiste en realizar varias diluciones secuenciales para alcanzar concentraciones muy bajas sin perder precisión volumétrica.
6. ¿Cómo evitar errores en el cálculo o la preparación de diluciones?
Verificar las unidades, usar volúmenes adecuados, etiquetar correctamente las soluciones, y realizar controles de calidad mediante mediciones analíticas.
7. ¿Qué hacer si se mezclan dos soluciones con concentraciones diferentes?
Se usa la fórmula del balance de masas:
para calcular la concentración final.
8. ¿Es posible diluir una solución más allá de su punto de saturación?
No, la saturación limita la concentración máxima del soluto en una solución. Diluir implica reducir la concentración, por lo que no hay problema, pero al intentar concentrar más allá de saturación, el soluto precipita.
9. ¿Cómo se registran y documentan las diluciones en laboratorio?
Según normativas como ISO 17025 y BPL, deben registrarse fecha, operador, lote de reactivos, material usado, y condiciones de preparación para garantizar trazabilidad y reproducibilidad.
10. ¿Dónde puedo encontrar estándares y guías oficiales para el cálculo y preparación de soluciones?
En documentos como la USP (Farmacopea de Estados Unidos), la IUPAC Gold Book, la ISO 17025 para laboratorios, y la EPA para aplicaciones ambientales.
Recursos Complementarios
- IUPAC Gold Book: Estándares de definiciones y nomenclatura en química
- NIST Chemistry WebBook: Datos fisicoquímicos confiables
- CDC Laboratory Biosafety Manual: Prácticas seguras en laboratorio
- USP-NF Online: Normas para soluciones farmacéuticas
- ISO.org: ISO 17025 completa
Este artículo constituye una guía integral para profesionales del laboratorio, industria farmacéutica, medioambiental y académica. Se recomienda adaptar los cálculos a los estándares de calidad y validación de cada sector.