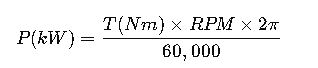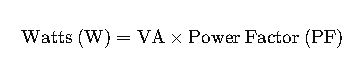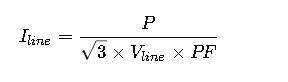Domina el cálculo de concentración en soluciones orgánicas mediante fórmulas precisas, comprensión y métodos confiables que revolucionan tus experimentos científicos.
Explora este artículo técnico donde se explican cálculos detallados de molaridad y porcentaje m/v, ofreciendo soluciones prácticas y ejemplos aplicados.
calculadora con inteligencia artificial (IA) – Cálculo de concentración de soluciones orgánicas (molaridad, % m/v, etc.)
- «Calcular la molaridad de una solución preparatoria a partir de 10 gramos de soluto disueltos en 250 mL de solución.»
- «Determinar el % m/v de una solución orgánica cuando se disuelven 5 g de soluto en 50 mL de disolvente.»
- «Conversión de concentración: evaluar la molaridad de una solución de ácido fórmico utilizando su densidad y masa molar.»
- «Obtener el cálculo de concentración (% m/v) para preparar una disolución estándar de etanol para aplicaciones experimentales.»
Cálculo de concentración de soluciones orgánicas: fundamentos y aplicaciones
El cálculo de concentración es fundamental en química analítica, bioquímica e ingeniería química. Conocer fórmulas como la molaridad y el porcentaje masa/volumen (% m/v) permite preparar y controlar soluciones con exactitud. En este contexto, abordaremos el diseño y ejecución de los cálculos para soluciones orgánicas, aplicando técnicas precisas y actualizadas.
Este contenido se estructura en secciones que abarcan desde la teoría de las concentraciones hasta ejemplos prácticos en el laboratorio. Encontrarás definiciones, fórmulas completas, tablas comparativas y casos de estudio reales para que adquieras un entendimiento profundo y aplicable.
Fundamentos Teóricos de la Concentración en Soluciones Orgánicas
Las soluciones orgánicas se preparan mediante la disolución de sustancias químicas en solventes orgánicos o acuosos. El cálculo de concentración es vital para asegurar la reproducibilidad en experimentos, cumplimiento normativo y seguridad en su manipulación. Las concentraciones se expresan en diferentes unidades y se obtienen mediante diversas fórmulas matemáticas.
Molaridad
La molaridad (M) es una de las unidades más utilizadas para expresar la concentración de una solución. Se define como el número de moles de soluto por litro de solución.
donde:
n = moles de soluto
V = volumen de solución en litros
La precisión en el cálculo de moles se basa en la masa molar del soluto, que permite convertir gramos a moles. La fórmula básica para determinar los moles es:
donde:
m = masa del soluto en gramos
Mmol = masa molar del soluto (g/mol)
La combinación de estas dos fórmulas nos permite planificar y preparar soluciones con la concentración deseada. La molaridad es especialmente importante en reacciones donde la relación molar entre reactivos es crítica.
% m/v (porcentaje masa/volumen)
El porcentaje masa/volumen se define como la cantidad de gramos de soluto contenido en 100 mL de solución. Es especialmente útil en aplicaciones médicas y farmacéuticas.
donde:
masa del soluto es expresada en gramos
volumen de la solución se expresa en mililitros
Esta unidad de medida facilita la preparación de concentraciones precisas, particularmente en hospitales y laboratorios clínicos, y garantiza que las soluciones se encuentren dentro de los parámetros seguros y eficaces para su utilización.
Otras Unidades y Conceptos en el Cálculo de Concentraciones
Existen otras unidades y métodos para expresar la concentración, como la normalidad, la molalidad y la fracción molar. Sin embargo, en el contexto de soluciones orgánicas, la molaridad y el % m/v son los más utilizados. Cada uno tiene sus ventajas, dependiendo del régimen experimental y la precisión requerida.
Normalidad (N)
La normalidad se define como el número de equivalentes de soluto por litro de solución. Aunque similar a la molaridad, la normalidad es útil en reacciones ácido-base y de precipitación donde el concepto de equivalente es crucial.
donde:
neq = número de equivalentes del soluto
V = volumen de solución en litros
Para convertir moles a equivalentes, se utiliza el factor de equivalencia, determinada por la reacción química en cuestión. Esto permite adaptar la unidad de concentración a procesos específicos y reacciones redox o ácido-base.
Molalidad (m)
La molalidad representa la cantidad de moles de soluto por kilogramo de disolvente, no de solución. Es especialmente útil en experimentos donde la temperatura varía significativamente, ya que depende de la masa y no del volumen.
donde:
n = moles del soluto
kg disolvente = masa del disolvente en kilogramos
La molalidad es una unidad que permanece invariable en condiciones de temperatura, lo cual es una ventaja en estudios termodinámicos y de propiedades coligativas.
Tablas de Conversión y Comparación de Unidades de Concentración
A continuación, se presenta una tabla comparativa que facilita la comprensión de las diferentes unidades de concentración y sus aplicaciones en el laboratorio.
| Concepto | Fórmula | Unidades | Aplicación |
|---|---|---|---|
| Molaridad | M = n / V | mol/L | Reacciones estequiométricas, análisis cuantitativo |
| % m/v | (g soluto/ mL solución) x 100 | g/100 mL | Preparaciones farmacéuticas, clínicos |
| Normalidad | N = neq / V | eq/L | Reacciones ácido-base, redox |
| Molalidad | m = n / kg disolvente | mol/kg | Estudios termodinámicos, propiedades coligativas |
Ejemplos Prácticos de Cálculo de Concentración de Soluciones Orgánicas
A continuación, se presentan casos de aplicación real que ilustran cómo utilizar las fórmulas y procedimientos de cálculo en un entorno experimental.
Caso de Estudio 1: Preparación de una Solución de Glucosa con % m/v
Contexto: Una farmacéutica requiere preparar una solución estandarizada de glucosa para estudios de osmolaridad en soluciones intravenosas. La especificación es obtener una solución al 5% m/v.
- Requerimientos: Se debe preparar 200 mL de solución.
- Cálculo en términos de % m/v: El 5% m/v implica 5 g de glucosa por cada 100 mL de solución.
Procedimiento y Cálculo:
- Determine la masa necesaria para 200 mL: (5 g/100 mL) x 200 mL = 10 g.
- Pesar 10 g de glucosa pura utilizando una balanza analítica.
- Disolver los 10 g de glucosa en un volumen menor a 200 mL de disolvente, y posteriormente ajustar el volumen final a 200 mL usando un matraz aforado.
- Verificar la homogeneidad de la solución.
Este procedimiento asegura que la solución final cumpla con la concentración requerida y se pueda utilizar en protocolos clínicos con alta precisión.
Caso de Estudio 2: Preparación de una Solución de NaCl de 0.5 M
Contexto: Un laboratorio de análisis químico necesita preparar 1 L de solución salina de NaCl con una concentración de 0.5 M para calibrar equipos de medición y realizar experimentos electroquímicos.
- Datos:
- Masa molar del NaCl = 58.44 g/mol
- Volumen requerido = 1 L
- Cálculo: Utilizando la fórmula de la molaridad: M = n / V, se requiere 0.5 moles de NaCl.
Procedimiento:
- Calcular la masa necesaria: m = n x Mmol = 0.5 moles x 58.44 g/mol = 29.22 g.
- Pesar 29.22 g de NaCl con precisión.
- Disolver el NaCl en un volumen de agua inferior a 1 L y transferir la disolución a un matraz aforado de 1 L.
- Ajustar el volumen final a 1 L con agua destilada y agitar vigorosamente.
El resultado es una solución salina de 0.5 M, que cumple con los estándares para experimentos de calibración y tiene alta reproducibilidad en pruebas electroquímicas.
Detalles Avanzados y Consideraciones Prácticas
El dominio del cálculo de la concentración en soluciones orgánicas involucra comprender factores termodinámicos, efectos de la temperatura y precisión volumétrica. Se debe considerar:
- Precisión volumétrica: Utilizar equipos de medición calibrados, como pipetas y matraces aforados, para evitar errores de medición.
- Pureza del soluto: Asegurarse de que el soluto esté libre de impurezas, lo que podría alterar la concentración real.
- Densidad del disolvente: En algunos casos, la densidad influye en la conversión entre unidades de concentración, siendo crucial en soluciones acuosas y orgánicas.
- Condiciones ambientales: La temperatura y la presión pueden afectar las mediciones volumétricas; por ello, se recomienda trabajar en condiciones controladas.
La elección de la unidad de concentración depende del tipo de análisis y la precisión requerida. La molaridad es ideal para reacciones en soluciones, mientras que el % m/v resulta muy práctico en aplicaciones farmacéuticas y médicas.
Diluciones y Transformaciones de Concentraciones
En muchos casos, es necesario preparar una solución diluida a partir de una más concentrada. El procedimiento de dilución se rige por la ley de la conservación de la materia:
donde:
Ci = concentración inicial
Vi = volumen inicial
Cf = concentración final
Vf = volumen final
Esta ley es aplicable a todo proceso de dilución y permite calcular el volumen necesario de un disolvente para alcanzar la concentración deseada sin alterar la cantidad de soluto.
Conversión entre Unidades de Concentración
A menudo, es necesario convertir entre unidades para comparar o ajustar experimentos. Por ejemplo, convertir de molaridad a % m/v requiere conocer la masa molar del soluto y la densidad de la solución cuando esta última varía significativamente.
- Molaridad a % m/v: Primero se calculan los moles del soluto, se determina la masa usando la masa molar y luego se expresa en gramos por 100 mL.
- % m/v a Molaridad: Se expresa la cantidad de gramos en función del volumen total y se divide por la masa molar para obtener los moles, considerando además la conversión de mililitros a litros.
Para una conversión precisa, es esencial tener los datos experimentales exactos. En muchos protocolos se complementa el proceso con medidas instrumentales directas y comparaciones estándar.
Aplicaciones Industriales y de Investigación
El cálculo de la concentración es utilizado en múltiples áreas. En la industria química, la producción de solventes y reactivos requiere de un control preciso. Por ejemplo, la elaboración de soluciones reactantes en la síntesis de polímeros depende críticamente de la correcta medición de las unidades de concentración.
En laboratorios de investigación, las soluciones orgánicas preparadas a medida son la base de experimentos de reacción, estudios de catálisis y desarrollo de nuevos materiales. La precisión en la concentración permite que los resultados sean reproducibles y comparables a nivel global.
Importancia en la Industria Farmacéutica
En la fabricación de medicamentos y productos biotecnológicos, las concentraciones deben estar dentro de márgenes muy específicos. Por ejemplo, la preparación de soluciones intravenosas, suspensiones y emulsiones requieren controles de calidad rigurosos, donde se utilizan técnicas de cálculo de molaridad y % m/v. Además, el control de la concentración afecta directamente la eficacia y la seguridad del producto final.
La normatividad internacional, respaldada en documentación de entidades como la FDA y la EMA, exige que cada fase de producción incluya controles volumétricos y de pureza, garantizando la integridad del producto farmacéutico.
Desarrollo Experimental y Ensayos de Certificación
En el ámbito de la investigación experimental, los ensayos de certificación en laboratorios acreditados requieren cálculos precisos de concentración. Por ejemplo, al verificar la eficiencia de catalizadores en reacciones orgánicas, un pequeño error en la medición de la concentración puede alterar significativamente los resultados de la reacción y, por ende, las conclusiones científicas.
La integración de sistemas automáticos y software de inteligencia artificial, como la calculadora presentada al inicio, permite a los científicos reducir los errores humanos y aumentar la confiabilidad en los procesos experimentales.
Procedimientos Prácticos y Buenas Prácticas de Laboratorio
Para asegurar la calidad en la preparación de soluciones, se deben seguir protocolos estandarizados:
- Verificación de Equipos: Calibrar pipetas, buretas y matraces aforados.
- Medición de Soluto: Utilizar balanzas de alta precisión y comprobar la pureza del reactivo.
- Control de Volumen: Ajustar el volumen final de la solución con disolventes precisos para evitar errores de concentración.
- Documentación Riguroso: Registrar cada paso del procedimiento, los datos experimentales y las condiciones ambientales.
Implementar estas buenas prácticas minimiza las fuentes de error y garantiza resultados reproducibles. La documentación y seguimiento de cada paso son fundamentales para la validación de métodos en laboratorios acreditados.
Casos de Aplicación Complementarios y Ejercicios Prácticos
Además de los ejemplos específicos ya presentados, se pueden plantear ejercicios para profundizar el entendimiento:
- Ejercicio 1: Determinar la molaridad de una solución preparada disolviendo 12 g de etanol (masa molar = 46.07 g/mol) en 250 mL de disolvente. Se debe calcular el número de moles y luego la concentración molar.
- Ejercicio 2: Calcular el % m/v de una solución en la que se disuelven 8 g de ácido acético en 80 mL de agua. Comparar el resultado con el método directo de cálculo de porcentajes.
La solución a estos ejercicios consiste en aplicar las fórmulas discutidas, verificando cada paso del procedimiento y asegurándose la correcta conversión de unidades. Estos ejercicios son útiles para estudiantes avanzados y profesionales que buscan reforzar sus conocimientos en el cálculo de concentraciones.
Nuevas Tendencias y Herramientas en el Cálculo de Concentraciones
El desarrollo de software y herramientas de inteligencia artificial ha simplificado el cálculo automático de concentraciones. Estas herramientas integran bases de datos con propiedades físicas y químicas, lo que permite resolver rápidamente cálculos complejos.
Además, sistemas de monitoreo en línea están siendo implementados en plantas industriales para ajustar en tiempo real las concentraciones de las soluciones, optimizando la eficiencia y reduciendo desperdicios. Estas innovaciones facilitan la integración entre la práctica experimental y la automatización de procesos.
Software de Cálculo y Automatización
Plataformas como MATLAB y Python han sido adaptadas en laboratorios para desarrollar scripts personalizados que calculan concentraciones a partir de datos en tiempo real. Esta integración permite:
- Analizar la variación de la concentración durante reacciones en cadena.
- Monitorear la estabilidad de soluciones en procesos de síntesis orgánica.
- Realizar ajustes automáticos en la dosificación de reactivos.
Estos sistemas complementan el trabajo manual y reducen los errores asociados a cálculos convencionales, ofreciendo mayor confiabilidad en la producción de soluciones con altas exigencias de precisión.
Implementación en el Aula y Capacitación Profesional
La incorporación de herramientas digitales en la educación superior ha permitido una mejor comprensión de los conceptos teóricos y prácticos. Programas interactivos y laboratorios virtuales ofrecen simulaciones de cálculos de concentraciones, ayudando a los estudiantes a visualizar los efectos de la variación de parámetros y mejorar su destreza en el manejo de las fórmulas.
Asimismo, cursos de actualización y seminarios técnicos en conferencias internacionales han incluido módulos dedicados al uso de estas nuevas tecnologías, lo que refuerza la conexión entre la formación académica y la necesidad industrial.
Preguntas Frecuentes (FAQ) sobre Cálculo de Concentración en Soluciones Orgánicas
-
¿Qué es la molaridad y por qué es importante?
La molaridad es la concentración en moles de soluto por litro de solución y es esencial para calcular las cantidades exactas en reacciones químicas, asegurando la correcta estequiometría.
-
¿Cómo se calcula el % m/v?
El % m/v se calcula dividiendo la masa del soluto en gramos entre el volumen de la solución en mililitros y multiplicando por 100, lo que indica cuántos gramos de soluto hay en cada 100 mL.
-
¿Cuándo debo usar molaridad versus molalidad?
Usa molaridad cuando el volumen de la solución es el parámetro clave y las condiciones de temperatura son estables. La molalidad es preferible en estudios termodinámicos, pues depende de la masa del disolvente.
-
¿Cómo se relacionan estas concentraciones con la seguridad en laboratorios?
Manejar correctamente la concentración evita errores en la preparación y dosificación de soluciones, ayudando a cumplir normativas de seguridad y eficiencia en los ensayos experimentales.
-
¿Existen herramientas automatizadas para realizar estos cálculos?
Sí, se han desarrollado aplicaciones y software de inteligencia artificial que facilitan el cálculo de concentraciones y la trazabilidad de las mediciones en entornos industriales y de investigación.
Recursos Adicionales y Enlaces de Interés
Para ampliar tu comprensión y obtener más ejemplos prácticos, considera explorar recursos adicionales en:
- Wikipedia – Molaridad
- Química en la Práctica: Soluciones y Disoluciones
- ScienceDirect – Preparación de Soluciones
- Diluciones y Preparación de Soluciones (Enlace Interno)
Resumen de Conceptos y Procedimientos Clave
El correcto cálculo de la concentración de soluciones orgánicas (molaridad, % m/v, etc.) es esencial para la reproducibilidad y precisión en trabajos de laboratorio. Recordemos algunos puntos clave:
- La molaridad se calcula como el número de moles de soluto por litro de solución.
- El % m/v indica la cantidad de gramos de soluto presentes en 100 mL de solución.
- La normalidad y la molalidad son unidades alternativas para aplicaciones específicas, fundamentadas en equivalentes y en la masa del disolvente respectivamente.
- La fórmula de dilución (Ci x Vi = Cf x Vf) es esencial para preparar soluciones a partir de concentrados.
- La implementación de herramientas de IA y software especializado mejora la eficiencia y reduce errores experimentales.
La integración de estos conceptos en procedimientos estandarizados y el uso de buenas prácticas de laboratorio son vitales para alcanzar la máxima precisión en la preparación de soluciones.
Tendencias Futuras y Avances Tecnológicos
A medida que las tecnologías avanzan, se espera que el uso de inteligencia artificial y algoritmos predictivos se integre de forma más profunda en los procesos de cálculo y control de concentraciones químicas. Los sistemas de monitoreo automatizados facilitarán la supervisión en tiempo real y podrán ajustar parámetros con base en modelos predictivos, lo cual optimizará la producción industrial y la investigación experimental.
Además, el desarrollo de plataformas colaborativas en línea, donde laboratorios y universidades comparten protocolos y resultados experimentales, potenciará la innovación y la estandarización en la preparación de soluciones químicas.
Consideraciones Finales para la Implementación Práctica
La aplicación de los conceptos de cálculo de concentración descritos en este artículo garantiza que tanto los procesos industriales como las investigaciones de laboratorio se beneficien de la exactitud y reproducibilidad