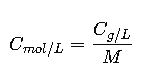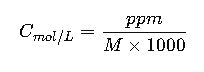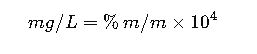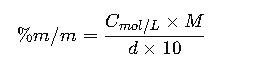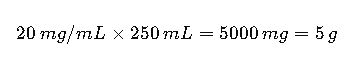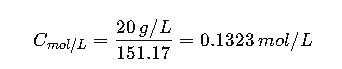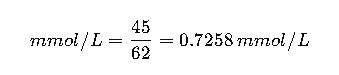La conversión de concentración es esencial en química, farmacia, ambiente, alimentos y control de calidad.
Este artículo explica unidades, fórmulas, ejemplos reales y tablas útiles para convertir con precisión profesional.
Conversor de Unidades de Concentración
1. Principales unidades de concentración y sus usos
Las unidades de concentración se clasifican según el tipo de relación que representan:
- Masa / volumen: g/L, mg/L, µg/mL
- Masa / masa: ppm, ppb, % m/m
- Volumen / volumen: % v/v
- Cantidad de sustancia / volumen: mol/L (molaridad), mmol/L
- Relaciones adimensionales: ppm, ppb
Estas unidades se utilizan en contextos específicos:
| Unidad | Expresión | Usos comunes |
|---|---|---|
| g/L | gramos por litro | Soluciones nutritivas, laboratorios clínicos |
| mg/L | miligramos por litro | Análisis de agua, alimentos, farmacéuticos |
| µg/mL | microgramos por mililitro | Análisis clínico, fármacos inyectables |
| % m/m | porcentaje masa a masa | Cosmética, productos de limpieza |
| % v/v | porcentaje volumen a volumen | Alcoholes, solventes |
| mol/L | moles por litro (molaridad) | Reacciones químicas, titulaciones |
| ppm | partes por millón | Aguas residuales, emisiones |
| ppb | partes por mil millones | Metales pesados, toxicología |
| meq/L | miliequivalentes por litro | Medicina, electroquímica |
2. Tablas extensas de conversión de unidades comunes
Tabla 1: Conversión entre masa / volumen
| De \ A | g/L | mg/L | µg/mL | ng/µL |
|---|---|---|---|---|
| 1 g/L | 1 | 1000 | 1000 | 1,000,000 |
| 1 mg/L | 0.001 | 1 | 1 | 1000 |
| 1 µg/mL | 0.001 | 1 | 1 | 1000 |
| 1 ng/µL | 0.000001 | 0.001 | 0.001 | 1 |
Tabla 2: Conversión entre molaridad y masa (según masa molar MM)
| Unidad origen | Unidad destino | Fórmula de conversión |
|---|---|---|
| mol/L | g/L | g/L = mol/L × MM |
| mmol/L | mg/L | mg/L = mmol/L × MM |
| g/L | mol/L | mol/L = g/L ÷ MM |
| mg/L | mmol/L | mmol/L = mg/L ÷ MM |
Ejemplo con glucosa (MM = 180.16 g/mol):
- 0.5 mol/L = 90.08 g/L
- 180 mg/L = 1 mmol/L
Tabla 3: Conversión entre unidades adimensionales
| Unidad origen | Equivalencia |
|---|---|
| 1 ppm | 1 mg/L (en agua) |
| 1 ppb | 1 µg/L (en agua) |
| 1 % m/m | 10,000 ppm |
| 1 % v/v | 10,000 ppm (si densidades ≈1) |
3. Fórmulas técnicas para conversión de unidades de concentración
De masa/volumen a molaridad
- C<sub>mol/L</sub>: concentración molar en mol/L
- C<sub>g/L</sub>: concentración en g/L
- M: masa molar en g/mol
De ppm a molaridad (en agua)
Ejemplo:
100 ppm NaCl = 0.00171 mol/L
De % m/m a mg/L (soluciones acuosas)
Ejemplo: 0.02 % m/m = 200 mg/L
De molaridad a % m/m (requiere densidad)
Donde d es la densidad (g/mL).
Importante: La conversión depende de una buena estimación de la densidad.
4. Casos de aplicación real: desarrollo y solución
Caso 1: Solución oral de paracetamol
Requerimiento: Solución al 2% m/v (20 mg/mL)
Volumen: 250 mL
Conversión a molaridad:
MM Paracetamol = 151.17 g/mol
Caso 2: Nitratos en agua potable
Muestra: 45 mg/L de NO₃⁻
Masa molar: 62.00 g/mol
Según la OMS, esto está por debajo del límite permitido.
Fuente: OMS Nitratos
5. Recursos de referencia y enlaces de autoridad
- IUPAC Gold Book – Concentration units
- USP General Chapters: <1225>
- EPA Water Quality Standards
- NIST Chemistry WebBook
6. Buenas prácticas para realizar conversiones de concentración
- Verifica la unidad base.
- Consulta masas molares con precisión.
- Ajusta por densidad si es necesario.
- Usa patrones trazables y certificados.
- Apóyate en software o calculadoras validadas.
7. Preguntas frecuentes sobre conversión de unidades de concentración
¿Qué diferencia hay entre ppm y mg/L?
En agua, son equivalentes si la densidad ≈ 1 g/mL.
¿Puedo convertir directamente entre % m/m y molaridad?
Solo si conoces la densidad y la masa molar.
¿Por qué es importante la masa molar?
Permite transformar masa en moles y viceversa.
¿Qué pasa si uso valores redondeados?
Puedes cometer errores. Usa al menos 4 cifras significativas.
¿Qué herramientas son recomendables?
Hojas de cálculo, calculadoras científicas, software especializado como ChemAxon.
¿Estas conversiones aplican en todos los solventes?
No. Las relaciones como ppm = mg/L solo se cumplen si el disolvente tiene densidad ≈ 1 g/mL.
¿Cuándo usar % m/m vs. % v/v?
- % m/m para sólidos o líquidos densos
- % v/v para líquidos miscibles con densidades similares