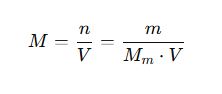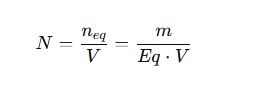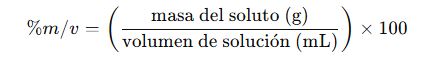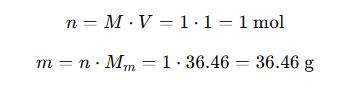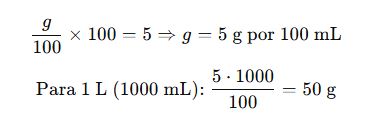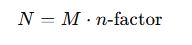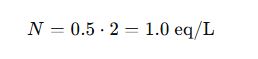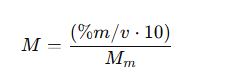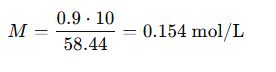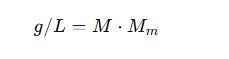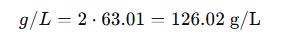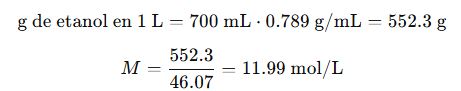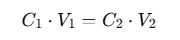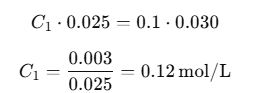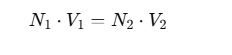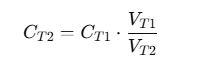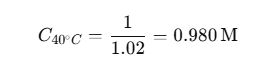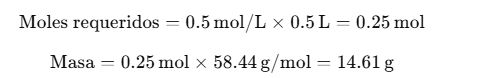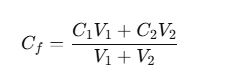El cálculo de concentración es clave en química, farmacología, alimentos y múltiples procesos industriales esenciales.
Permite saber el soluto exacto en solución para formular, controlar calidad y garantizar reacciones precisas.
Calculadora de Concentración
Tablas extensas de valores comunes en concentración
A continuación se presentan tablas de referencia con valores comunes utilizados en laboratorios e industrias para las distintas formas de concentración.
Tabla 1: Valores comunes de Molaridad (mol/L)
| Soluto | Masa molar (g/mol) | M (mol/L) | g/L necesarios |
|---|---|---|---|
| NaCl (Cloruro de sodio) | 58.44 | 0.1 | 5.84 |
| 0.5 | 29.22 | ||
| 1.0 | 58.44 | ||
| HCl (Ácido clorhídrico) | 36.46 | 0.1 | 3.65 |
| 1.0 | 36.46 | ||
| NaOH (Hidróxido de sodio) | 40.00 | 0.1 | 4.00 |
| 1.0 | 40.00 | ||
| KMnO₄ (Permanganato potásico) | 158.04 | 0.01 | 1.58 |
| 0.1 | 15.80 |
Tabla 2: Valores comunes de Normalidad (eq/L)
| Soluto | Equivalente g/eq | N (eq/L) | g/L necesarios |
|---|---|---|---|
| H₂SO₄ (Ácido sulfúrico) | 49.04 | 1.0 | 98.08 |
| 2.0 | 196.16 | ||
| HCl | 36.46 | 1.0 | 36.46 |
| NaOH | 40.00 | 1.0 | 40.00 |
| Ba(OH)₂ | 85.49/2 = 42.75 | 1.0 | 85.50 |
Tabla 3: % m/v – Porcentaje masa/volumen (g/100 mL)
| Soluto | % m/v | g disueltos en 100 mL | g/L |
|---|---|---|---|
| NaCl | 0.5 | 0.5 | 5 |
| 1.0 | 1.0 | 10 | |
| 5.0 | 5.0 | 50 | |
| Glucosa | 5.0 | 5.0 | 50 |
| 10.0 | 10.0 | 100 |
Tabla 4: % v/v – Porcentaje volumen/volumen (mL/100 mL)
| Soluto (líquido) | % v/v | mL de soluto en 100 mL de solución | mL/L |
|---|---|---|---|
| Etanol | 10 | 10 | 100 |
| 70 | 70 | 700 | |
| 95 | 95 | 950 | |
| Ácido acético | 5 | 5 | 50 |
| 10 | 10 | 100 |
Fórmulas para el cálculo de concentración
1. Molaridad (M)
- M: Molaridad (mol/L)
- n: Número de moles del soluto (mol)
- m: Masa del soluto (g)
- Mₘ: Masa molar del soluto (g/mol)
- V: Volumen de la solución (L)
Valores comunes:
- Volúmenes típicos: 0.1 L (100 mL), 0.25 L, 1.0 L
- Molaridades típicas: 0.1 M, 0.5 M, 1 M, 2 M
2. Normalidad (N)
- N: Normalidad (eq/L)
- nₑq: Equivalentes-gramo del soluto (eq)
- Eq: Equivalente-gramo del soluto (g/eq) = masa molar / n-factor
- n-factor: Número de H⁺ o OH⁻ aportados o e⁻ intercambiados
Valores comunes:
- HCl: n-factor = 1
- H₂SO₄: n-factor = 2
- NaOH: n-factor = 1
3. Porcentaje masa/volumen (% m/v)
- Usado comúnmente en bioquímica y farmacia
- Ejemplo común: Suero glucosado al 5% m/v
4. Porcentaje volumen/volumen (% v/v)
- Utilizado en mezclas de líquidos miscibles, como etanol-agua
Ejemplos del mundo real
Ejemplo 1: Preparación de solución de HCl 1 M a partir de concentrado al 37%
Datos:
- HCl concentrado: 37% p/p, densidad = 1.19 g/mL
- Masa molar = 36.46 g/mol
- Deseamos: 1 L de solución 1 M
Paso 1: Calcular masa necesaria
Paso 2: Determinar volumen del concentrado requerido
Resultado:
Diluir 82.82 mL de HCl concentrado a 1 L con agua destilada para obtener 1 M de HCl.
Ejemplo 2: Preparación de solución glucosada al 5% m/v para hospital
Datos:
- Deseamos: 1 L de solución glucosada al 5% m/v
- % m/v = (g/100 mL) × 100
Paso 1: Calcular masa requerida
Resultado:
Disolver 50 g de glucosa en agua destilada y aforar a 1 L.
Conversiones útiles entre diferentes unidades de concentración
En muchos contextos es necesario convertir entre diferentes unidades de concentración. A continuación, se muestran algunas conversiones frecuentes con fórmulas y ejemplos.
De Molaridad (M) a Normalidad (N)
Ejemplo: Ácido sulfúrico (H₂SO₄) tiene un n-factor de 2 (puede donar 2 H⁺).
- Si M = 0.5 mol/L →
De % m/v a Molaridad (M)
Ejemplo: Solución de NaCl al 0.9% m/v (suero fisiológico), con Mₘ = 58.44 g/mol
De Molaridad (M) a g/L
Ejemplo: HNO₃ a 2 M → Mₘ = 63.01 g/mol
De % v/v a Molaridad (M) (solo para líquidos miscibles y conocidos)
Esta conversión requiere conocer la densidad y la masa molar del soluto líquido. En el caso del etanol:
Ejemplo: Etanol al 70% v/v, densidad = 0.789 g/mL, Mₘ = 46.07 g/mol
Aplicaciones industriales y farmacéuticas
El cálculo de concentración es esencial en muchas industrias. A continuación, se listan algunas aplicaciones destacadas:
1. Industria farmacéutica
- Preparación de soluciones intravenosas (ej. suero glucosado al 5%)
- Dosificación precisa de principios activos (mg/mL, % m/v)
- Validación de métodos analíticos (USP, EMA, ICH Q2)
2. Industria alimentaria
- Formulación de conservantes y saborizantes
- Medición de contenido alcohólico (% v/v en bebidas)
- Análisis de aditivos (ppm, % m/v)
3. Tratamiento de aguas
- Dosificación de cloro y floculantes
- Medición de contaminantes (mg/L, M)
4. Industria química y petroquímica
- Control de procesos mediante titulaciones (Normalidad)
- Ajuste de soluciones reactivas según reacciones estequiométricas
Normativas internacionales relacionadas
El cálculo y expresión de concentraciones está regulado por normativas y estándares internacionales. Entre los más importantes se encuentran:
| Organismo | Norma o Guía | Aplicación principal |
|---|---|---|
| USP | USP <831> | Ensayos de soluciones y diluciones |
| ICH | Q2(R2) | Validación de métodos analíticos |
| AOAC | Official Methods Manual | Métodos analíticos en alimentos y fármacos |
| ISO | ISO 7218, ISO 17025 | Análisis en laboratorios acreditados |
Errores comunes al preparar soluciones
A continuación, una lista de errores frecuentes al calcular o preparar soluciones, y cómo evitarlos:
| Error común | Consecuencia | Solución recomendada |
|---|---|---|
| No ajustar el volumen final tras disolver | Molaridad incorrecta | Aforar siempre después de disolver |
| Usar el volumen del soluto en lugar del total | Subestimar % v/v | Calcular respecto al volumen final, no parcial |
| No considerar densidad en líquidos concentrados | Error en cantidad real de soluto | Usar densidad siempre para pasar a g o mL |
| Redondear en exceso | Cálculos acumulativamente erróneos | Mantener al menos 4 cifras significativas |
| No considerar el n-factor en Normalidad | Cálculos erróneos en titulaciones | Verificar n-factor químico del soluto |
Calculadora de concentración HTML/JS
Como complemento al artículo, te puedo integrar una calculadora personalizable para calcular:
- Molaridad a partir de gramos y volumen
- Normalidad a partir del n-factor
- % m/v y % v/v
- Conversión entre unidades
Aplicaciones avanzadas en titulaciones ácido-base y redox
Una de las aplicaciones más relevantes del cálculo de concentración es en titulaciones ácido-base y redox, fundamentales en química analítica.
Fórmulas para titulaciones ácido-base
Para una titulación ácido-base con una relación 1:1 entre H⁺ y OH⁻ (por ejemplo, HCl con NaOH):
Donde:

Caso real: Titulación de HCl con NaOH
Problema: Se titulan 25 mL de una solución de HCl con una solución de NaOH 0.1 M. Se gastan 30 mL de NaOH. ¿Cuál es la concentración de HCl?
Solución:
Por tanto, la concentración del HCl es 0.12 M.
Titulaciones redox (con equivalentes)
Cuando la relación no es 1:1 (por ejemplo, permanganato con hierro):
Donde:
- N es la normalidad, relacionada con el número de electrones intercambiados.
Errores comunes en el cálculo de concentración
Cometer errores en estos cálculos puede derivar en soluciones peligrosas o resultados inválidos. Algunos errores frecuentes incluyen:
1. Uso incorrecto de unidades
- Confundir g/L con % m/v.
- Usar mL en lugar de L sin convertir puede alterar totalmente la molaridad calculada.
2. Densidad mal aplicada en % v/v
- El % v/v implica ambos volúmenes en las mismas unidades. Usar densidad para convertir g a mL sin entender esto lleva a errores sistemáticos.
3. Número de equivalentes mal interpretado
- En soluciones redox, no considerar el número de electrones transferidos da lugar a normalidades mal calculadas.
Recomendación:
- Usar hojas de cálculo con fórmulas verificadas.
- Siempre convertir unidades al sistema internacional antes de operar.
Influencia de la temperatura y densidad
Efecto de la temperatura sobre la concentración
A medida que la temperatura aumenta, los líquidos se expanden, lo que reduce la concentración si el número de moles permanece constante.
Esto es crítico en laboratorios de precisión o farmacéuticos.
Ejemplo:
Una solución 1 M de H₂SO₄ preparada a 20 °C ocupa 1 L. A 40 °C el volumen se expande a 1.02 L:
La diferencia puede ser crítica en reacciones sensibles.
Conversión entre diferentes unidades de concentración
Los diferentes sistemas pueden dificultar la interpretación si no se manejan adecuadamente. Aquí una tabla guía útil:
Tabla de conversión entre unidades de concentración
| De | A | Fórmula de conversión | Notas |
|---|---|---|---|
| Molaridad a % m/v | % m/v = (M × PM × 100) / 1000 | PM: peso molar en g/mol | |
| % m/v a Molaridad | M = (% m/v × 10) / PM | ||
| % m/v a ppm | ppm = % m/v × 10,000 | Solo para soluciones diluidas | |
| ppm a % m/v | % m/v = ppm / 10,000 | ||
| % v/v a ppm | ppm = % v/v × 10,000 | Suponiendo densidad ≈ agua | |
| Normalidad a Molaridad | M = N / n | n = número de equivalentes por mol |
Normativas internacionales aplicables
El uso de concentraciones químicas está normado por organismos de regulación científica:
Principales referencias
- USP (United States Pharmacopeia): especifica cómo preparar soluciones estándar para ensayos de laboratorio.
- ICH Q2(R1): regula la validación de métodos analíticos, incluyendo concentraciones.
- ASTM D1293: regula soluciones tampón y estándares de pH.
- EMA (European Medicines Agency): controla concentraciones en soluciones inyectables.
Más información puede encontrarse en:
Preguntas frecuentes (FAQ)
¿Cuál es la diferencia entre molaridad y normalidad?
La molaridad mide moles por litro. La normalidad mide equivalentes por litro. En ácidos y bases, un mol puede liberar más de un H⁺ u OH⁻.
¿Cuándo se usa % m/v en lugar de molaridad?
Cuando se preparan soluciones sin necesidad de precisión estequiométrica, o para soluciones comunes como suero fisiológico (0.9% m/v NaCl).
¿Cómo preparo una solución al 0.5 M de NaCl en 500 mL?
Disolver 14.61 g de NaCl en agua destilada y completar a 500 mL.
¿Qué pasa si mezclo dos soluciones de diferente concentración?
Se aplica la fórmula:
Consideraciones finales y recomendaciones técnicas para el cálculo de concentración
El dominio del cálculo de concentración —ya sea mediante molaridad (M), normalidad (N), porcentaje masa/volumen (% m/v) o porcentaje volumen/volumen (% v/v)— es esencial en cualquier área que implique manipulación de soluciones, desde la química analítica hasta la producción industrial.
Una correcta preparación y cuantificación de soluciones garantiza la reproducibilidad de experimentos, la eficacia de procesos industriales y, en contextos clínicos y farmacéuticos, la seguridad del paciente y la eficacia terapéutica.
Recomendaciones clave para profesionales y técnicos:
- Verifique unidades y densidades antes de calcular.
Muchas soluciones concentradas están expresadas en % m/m, % m/v o en fracciones molares, y asumir incorrectamente la unidad puede llevar a errores graves. - Utilice equipo calibrado de laboratorio.
El uso de material volumétrico certificado (matraces aforados, pipetas automáticas, balanzas analíticas) es crucial para minimizar errores de medición. - Ajuste por temperatura si es necesario.
El volumen de líquidos varía con la temperatura. En laboratorios de precisión, asegúrese de ajustar a 20 °C o 25 °C según normativa. - Calcule normalidad solo cuando se conozca el número de equivalentes.
Especialmente en soluciones ácidas, básicas u oxidantes/reductoras, conocer los equivalentes por mol es indispensable. - Documente y valide cada preparación de soluciones.
Para industrias reguladas como la farmacéutica (cumpliendo normativas como USP, EMA, ISO 17025), es obligatorio mantener trazabilidad completa de cálculos, lotes y fechas. - Consulte tablas de referencia y literatura confiable.
Recursos como el CRC Handbook of Chemistry and Physics, la USP-NF y manuales de la IUPAC ofrecen datos precisos de densidades, pesos molares y factores de equivalencia. - Capacite al personal técnico en técnicas volumétricas y gravimétricas.
Errores humanos por falta de conocimiento en dilución, aforo y pesado son comunes. La formación continua reduce estos errores sistemáticamente. - Implemente controles de calidad en cada lote de solución preparada.
La verificación mediante titulaciones estándar o espectrofotometría ayuda a confirmar la concentración real y detectar errores tempranos.
Aplicación práctica intersectorial
El conocimiento profundo del cálculo de concentración es aplicado en:
- Laboratorios clínicos: preparación de sueros, diluciones en pruebas ELISA, titulaciones de electrolitos.
- Industria farmacéutica: fabricación de jarabes, soluciones inyectables, soluciones oftálmicas.
- Industria alimentaria: formulación de conservantes, corrección de pH y contenido salino.
- Medio ambiente: análisis de contaminantes en agua y suelo (ppm, ppb convertibles desde % m/v).
- Ingeniería química: diseño de reactores y procesos de separación.